Chimica Generale. Principi ed applicazioni moderne
Petrucci - Herring - Madura - Bissonette
47,00 €
TAVOLA PERIODICA IN OMAGGIO
PREFAZIONE
“Conosci il tuo pubblico”. Per questa nuova edizione abbiamo cercato di seguire questo importante consiglio per venire ancor più incontro ai bisogni degli studenti che si inoltrano nel difficile viaggio nella chimica. Sappiamo che gran parte degli studenti di chimica generale ha progetti di carriera non necessariamente in chimica, ma in altre aree come la biologia, la medicina, l’ingegneria, le scienze ambientali e l’agraria. Capiamo anche che il corso di chimica generale potrebbe essere l’unica occasione in cui alcuni studenti universitari avranno l’opportunità di accostarsi alla chimica. Abbiamo scritto questo libro per loro. Comunque, anche gli studenti che vogliono diventare chimici troveranno opportunità in questo testo per soddisfare i loro dubbi e coltivare i loro
interessi.
Sebbene sia utile aver già studiato chimica, non serve avere già nozioni di chimica per usare questo testo, perché i primi capitoli sono pensati per coloro che non hanno alcuna conoscenza preliminare o semplicemente per coloro che devono rinfrescarsi la memoria.
Lo studente avrà bisogno di identificare ed applicare i principi e di visualizzare il loro significato fisico. Gli strumenti pedagogici di questo testo sono stati ideati per fornire il necessario aiuto in questo compito.Allo stesso tempo, speriamo che il libro serva a rendere più acute le capacità di risoluzione dei problemi e di pensiero critico dello studente. Abbiamo perciò cercato un giusto
bilanciamento tra principi ed applicazioni, discussioni qualitative e quantitative e tra rigore e semplificazione.
In tutto il testo abbiamo fornito esempi tratti dal mondo reale per completare la discussione. Si trovano dappertutto esempi tratti dalle scienze biologiche, dall’ingegneria e dalle scienze ambientali. Questo dovrebbe aiutare a rendere più viva la chimica, sottolineando così quanto essa sarà rilevante nella carriera futura di ognuno, oltre a chiarire e far padroneggiare i concetti di base.
ORGANIZZAZIONE
In questa edizione manteniamo l’organizzazione di base delle precedenti edizioni, con due significative eccezioni. Per prima cosa, abbiamo anticipato il capitolo intitolato “Trasformazioni spontanee: entropia ed energia di Gibbs”, che è ora il Capitolo 13. Trattando prima l’entropia e l’energia di Gibbs, possiamo utilizzare questi concetti nei capitoli successivi. Abbiamo inoltre spostato il capitolo sulla cinetica chimica al Capitolo 20. Di conseguenza, la discussione della cinetica appare dopo i capitoli che introducono i concetti dell’equilibrio e della termodinamica.
Come nelle precedenti edizioni, questa inizia con una breve introduzione dei concetti chiave nel Capitolo 1. Quindi, introduciamo la teoria atomica, compresa la tavola periodica, nel Capitolo 2. La tavola periodica è uno strumento straordinariamente utile e presentarla presto ci consente di usarla fin dai primi capitoli del testo. Nel Capitolo 3 introduciamo i composti chimici e la loro stechiometria. In questa presentazione sono inclusi anche i composti organici. L’introduzione nei primi capitoli dei composti organici ci consentirà di sfruttarli come esempi in tutto il libro. I Capitoli 4 e 5 introducono le reazioni chimiche. Discutiamo i gas nel Capitolo 6, in parte perché sono familiari agli studenti, ma anche perché molti docenti preferiscono affrontare questo argomento presto per integrarlo meglio nei loro programmi di lezione e laboratorio. Si noti che il Capitolo 6 può essere comunque affrontato
in seguito, per studiarlo assieme agli altri stati della materia, nel Capitolo 12. Nel Capitolo 7, introduciamo la termochimica e discutiamo le variazioni di energia che accompagnano le trasformazioni chimiche e fisiche. Il Capitolo 8 presenta i concetti quantomeccanici che servono per capire le variazioni di energia che incontriamo a livello atomico. In questo capitolo c’è anche una discussione della meccanica ondulatoria, tale però per cui il docente possa escludere senza problemi questo capitolo se il livello del corso lo richieda. Insieme, i Capitoli da 8 a 11 forniscono le basi concettuali per descrivere la struttura elettronica di atomi e molecole e le proprietà chimiche e fisiche di queste entità. Le proprietà di atomi e molecole vengono poi usate nel Capitolo 12 per razionalizzare le proprietà di solidi e liquidi. Il Capitolo 13 è una significativa revisione del Capitolo 19 della decima edizione.
Introduce il concetto di entropia, i criteri per prevedere la direzione di una trasformazione spontanea e la condizione di equilibrio termodinamico. Nei Capitoli 14–19 applichiamo ed estendiamo i concetti introdotti nel Capitolo 13. Tuttavia, i Capitoli 14–19 possono essere insegnati senza esplicitamente far riferimento al Capitolo 13.
Come nelle precedenti edizioni, abbiamo enfatizzato la chimica del mondo reale negli ultimi capitoli che si occupano di chimica descrittiva (Capitoli 21–24) ed abbiamo cercato di rendere questo materiale facile da spostare prima nel programma del corso. Inoltre, molti argomenti di questi capitoli possono essere affrontati da soli, senza aver bisogno di studiare i capitoli interi. Il testo finisce con dei completi capitoli sulla chimica nucleare (Capitolo 25), sulla chimica organica (Capitoli 26 e 27) e sulla biochimica
(Capitolo 28).
NOVITÀ DI QUESTA EDIZIONE
Abbiamo anche apportato significativi cambiamenti in capitoli ed appendici specifici:
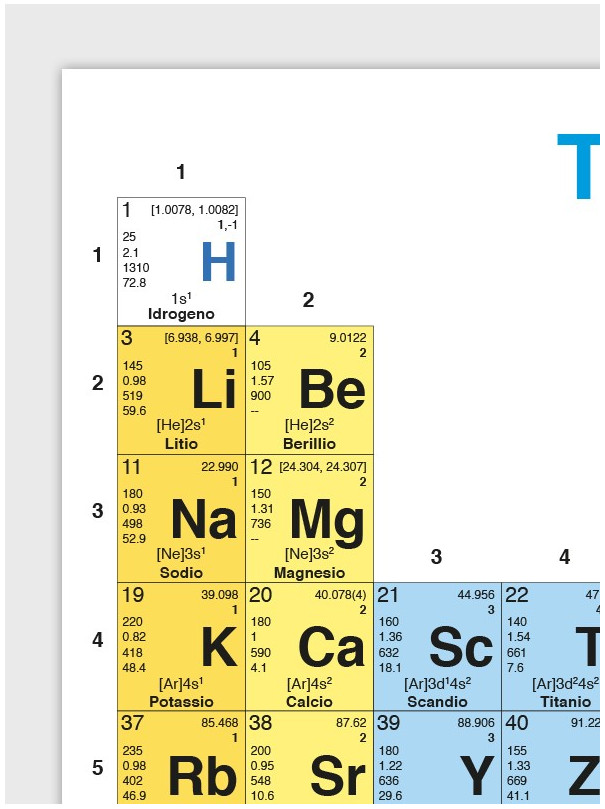
• Nel Capitolo 2 (Atomi e teoria atomica) è stato incluso nuovo materiale per descrivere l’uso degli intervalli di massa atomica e delle masse atomiche convenzionali per elementi come H, Li, B, C, N, O,Mg, Si, S, Cl, Br e Tl. Gli intervalli di massa atomica sono raccomandati dalla IUPAC perché le abbondanze isotopiche di questi elementi variano da una fonte all’altra e, quindi, le loro masse atomiche non possono essere considerate costanti.
• Il Capitolo 4 (Reazioni chimiche) comprende una nuova sezione che discute l’avanzamento della reazione ed introduce un approccio tabulare per rappresentare le variazioni di quantità in termini di una sola variabile, che indica il grado di avanzamento di reazione.
• Nel Capitolo 5 (Introduzione alle reazioni in soluzione acquosa) abbiamo rivisto la Sezione 5-1 per differenziare tra dissociazione e ionizzazione. Abbiamo anche introdotto una nuova figura per illustrare la dissociazione di un composto ionico in acqua.
• Il Capitolo 6 (Gas) fa maggior uso delle unità di pressione raccomandate (ad es. Pa, kPa e bar). La Sezione 6-7 sulla teoria cinetico-molecolare è stata ampiamente rivista. Per esempio, la sottosezione sulla derivazione della legge di Boyle è stata semplificata ed ora segue le sottosezioni sulla distribuzione delle velocità molecolari e sul significato della temperatura. Anche la Sezione 6-8 è stata aggiornata, in modo da presentare per prima la legge di Graham come legge empirica, per poi giustificarla in
base alla teoria cinetico-molecolare.
• Nel Capitolo 7 (Termochimica), abbiamo aggiornato la notazione secondo le raccomandazioni della IUPAC. Per esempio, le entalpie standard di reazione sono rappresentate dal simbolo (non ) e sono espresse in kJ mol (non kJ). Abbiamo aggiunto -1 un’interpretazione molecolare delle capacità termiche specifiche (nella Sezione 7-2) e un’introduzione all’entropia (nella Sezione 7-10).
• Il Capitolo 8 (Elettroni negli atomi) è stato riscritto per dare un’introduzione logica alle idee che portano alla meccanica ondulatoria. Le Sezioni 8-2 e 8-3 dell’edizione precedente sono state combinate assieme ed il materiale è stato riorganizzato. Questo capitolo comprende una nuova sezione che si concentra sul diagramma dei livelli energetici e sullo spettro dell’atomo di idrogeno. La sezione intitolata “interpretare e rappresentare gli orbitali dell’atomo di idrogeno” è stata riscritta e include ora una discussione delle funzioni radiali. È stata aggiunta una nuova sottosezione che descrive il modello concettuale degli atomi multielettronici, nel contesto della sezione intitolata “atomi multielettronici”. Le sezioni sugli atomi multielettronici e le configurazioni elettroniche sono state riviste per enfatizzare in modo più esplicito che la configurazione elettronica di stato fondamentale di un atomo è quella che minimizza Eatomo e che le energie degli orbitali non sono le uniche da considerare. Ci sono
due nuovi riquadri di approfondimento in questo capitolo: “l’interpretazione di Born è un concetto che usiamo per determinare la forma finale di una funzione d’onda?” e “sono concesse tutte le transizioni tra orbitali negli spettri di assorbimento ed emissione atomici?”
• Nel Capitolo 9 (Tavola periodica e alcune proprietà atomiche) sono state riscritte diverse sezioni, per enfatizzare l’importanza della carica nucleare efficace per determinare le proprietà atomiche. È stata introdotta una nuova sezione sulla polarizzabilità. Sono state create diverse nuove figure per illustrare la variazione della carica nucleare efficace e le proprietà atomiche lungo un periodo o un gruppo (per esempio, le cariche nucleari efficaci dei primi 36 elementi; la variazione della carica nucleare efficace e la schermatura percentuale in funzione del numero atomico; la variazione di distanza media dal nucleo, in funzione del numero atomico; le energie di prima ionizzazione degli elementi della terza riga del blocco p; le affinità elettroniche di alcuni elementi dei gruppi principali; la polarizzazione di un atomo; la variazione di polarizzabilità e volume atomico con il numero atomico). Le sezioni sulle energie di ionizzazione e sulle affinità elettroniche sono state riviste in modo sostanziale. In particolare, abbiamo aggiornato la discussione sulla diminuzione di energia di ionizzazione che si osserva spostandosi dal gruppo 2 al 13 e dal gruppo 15 al 16. La nostra discussione presenta le varie spiegazioni proposte per questi fenomeni. La sezione che nella decima edizione era intitolata “proprietà periodiche degli elementi” è stata eliminata.
• Nel Capitolo 11 (Legame chimico II: teorie del legame di valenza e degli orbitali molecolari) sono state aggiunte una discussione sulla ridistribuzione della densità elettronica che avviene durante la formazione di un legame, una miglior introduzione della Sezione 11-5 sulla teoria degli orbitali molecolari ed una discussione migliorata della teoria degli orbitali molecolari della molecola di CO.
• Il Capitolo 13 (Trasformazioni spontanee: entropia ed energia di Gibbs) è una versione completamente rivista del Capitolo 19 della precedente edizione. Il capitolo si concentra per prima cosa sulla visione di Boltzmann dell’entropia, che si basa suimicrostati, e poi sulla visione di Clausius, che correla la variazione di entropia al trasferimento reversibile di calore. Il collegamento tra microstati e modello della particelle in una scatola viene sviluppato per rinforzare la lettura di Boltzmann dell’entropia. La visione
di Clausius della variazione di entropia viene utilizzata per sviluppare le espressioni per comuni ed importanti trasformazioni fisiche (ad es. le transizioni di fase, il riscaldamento o il raffreddamento a pressione costante, l’espansione o la compressione isoterma di un gas ideale). Queste espressioni vengono poi utilizzate per sviluppare il criterio per prevedere la direzione della trasformazione spontanea. Il capitolo comprende un’accurata descrizione della differenza tra variazione di energia di Gibbs di un sistema, , e l’energia di Gibbs di una reazione, . L’energia di Gibbs di reazione ( ) si usa come base per descrivere come l’energia di Gibbs di un sistema vari con la composizione, cioè rispetto all’avanzamento della reazione. La derivazione dell’equazione viene fatta in una sezione separata che può essere utilizzata o meno, a discrezione del docente. Vengono inoltre introdotti i concetti di potenziale
chimico e di attività.
• Nel Capitolo 14 (Soluzioni e loro proprietà fisiche) abbiamo aggiunto una sezione per descrivere le proprietà termodinamiche standard degli ioni in acqua. Usiamo i concetti di entropia e potenziale chimico del Capitolo 13 per spiegare l’abbassamento della tensione di vapore e perché benzina ed acqua non si mescolano.
• Il Capitolo 15 (Principi dell’equilibrio chimico) è stato significativamente rivisto per enfatizzare la base termodinamica dell’equilibrio e per ridimensionare gli aspetti di cinetica. Si sottolinea il ruolo della costante di equilibrio termodinamica, espressa in termini di attività, oltre ad una discussione aggiornata del principio di Le Châtelier che ne chiarisca i limiti di utilizzo (ad es. per certe reazioni ed in certe condizioni, l’aggiunta di un reagente può spostare la reazione a sinistra). Sono stati inseriti diversi nuovi esempi, per mostrare come si possano semplificare le espressioni della costante di equilibrio e come si risolvano i problemi in cui la costante di equilibrio sia molto piccola o molto grande.
• Nel Capitolo 16 (Acidi e basi) sono stati fatti rilevanti cambiamenti. Le Sezioni da 16-1 a 16-3 sono state revisionate per migliorare la sequenza logica degli argomenti e per sottolineare che la differenza tra acidi forti e deboli si basa sul grado di ionizzazione, che a sua volta dipende dal valore della costante di ionizzazione acida. Ci sono due nuove sezioni, le Sezioni 16-7 (Reazioni acido-base simultanee o consecutive: un approccio generale) e 16-9 (Aspetti qualitativi delle reazioni acido-base). La Sezione 16-7 si concentra sulla scrittura e sull’uso di equazioni di bilancio di materia e carica. La Sezione 16-9 si occupa della previsione della posizione di equilibrio di una generica reazione acido–base. È stata aggiunta una nuova sottosezione intitolata “Razionalizzazione delle forze degli acidi: un approccio alternativo”, inserita nella Sezione 16-10 (Struttura molecolare e comportamento acido–base). Questa nuova sottosezione si concentra sui fattori che stabilizzano l’anione formato da un acido.
• Nel Capitolo 19 (Elettrochimica) abbiamo modificato l’equazione di Nernst, nella forma .Abbiamo cambiato il testo, inmodo da definire l’elettrodo standard a idrogeno rispetto alla pressione di 1 bar invece che di 1 atmed abbiamo aggiunto un problema a fine capitolo per illustrare che questamodifica provoca solo una piccola differenza nei potenziali standard di riduzione (Esercizio 108). Abbiamo anche aggiunto una sezione sulle batterie di riserva.
Oltre alle modifiche specifiche appena descritte, abbiamo anche rinnovato molte delle immagini in tutto il libro. In particolare, sono statemodificate tutte le rappresentazioni di orbitali atomici e molecolari, che ora sono coerenti in tutti i capitoli. Abbiamo anche ridisegnato le mappe del potenziale elettrostatico, in modo che abbiano la stessa scala di colori dell’energia di potenziale, eccetto dove espressamente indicato nel testo.
APPROCCIO GENERALE
In questa edizione, gli strumenti pedagocici e l’approccio generale continuano a riflettere le più moderne linee guida sull’insegnamento della chimica generale. Abbiamo mantenuto le seguenti caratteristiche chiave del testo:
• Approccio logico alla soluzione dei problemi. Tutti gli esempi risolti sono presentati nel testo usando una struttura tripartita di Analisi-Soluzione-Verifica. Questa presentazione non solo incoraggia gli studenti ad usare un approccio logico nel risolvere i problemi, ma consente loro di trovare un modo per cominciare quando affrontano un problema che sembra, all’inizio, irrisolvibile. L’approccio è quello implicitamente usato da coloro che hanno una consolidata esperienza nel risolvere i problemi, ma per coloro che iniziano il loro percorso di studi la struttura Analisi-Soluzione-Verifica serve a ricordare agli studenti che si deve (1) analizzare
le informazioni e pianificare una strategia, (2) implementare la strategia e (3) verificare la risposta per assicurarsi che sia ragionevole.
• Esempi pratici integrativi ed esercizi di fine capitolo. Chi ha usato le precedenti edizioni ha accolto con favore la qualità degli Esempi integrativi al termine di ciascun capitolo e la varietà degli esercizi di fine capitolo. Abbiamo aggiunto due esempi pratici (Esempio Pratico A e Esempio Pratico B) per ciascun Esempio integrativo nel testo. Invece di sostituire gli esercizi di fine capitolo con esercizi nuovi, abbiamo scelto di aumentarne il numero. In gran parte dei capitoli sono stati aggiunti almeno 10 nuovi esercizi ed in molti altri anche più di 20.
• Uso delle raccomandazioni IUPAC. Siamo orgogliosi che il nostro libro sia adottato da professori e studenti di tutto il mondo. Dato che la comunicazione tra scienziati in generale, e tra chimici in particolare, viene facilitata se si usano termini e notazioni comuni, abbiamo deciso di seguire, con relativamente poche eccezioni, le raccomandazioni della International Union of Pure and Applied Chemistry (IUPAC). In particolare, la versione della tavola periodica che appare nel testo è basata su quella oggi accettata dalla IUPAC. Questa versione approvata dalla IUPAC pone gli elementi lantanio (La) e attinio (Ac) rispettivamente tra i lantanidi e gli attinidi e non nel gruppo 3. È curioso che ancor oggi praticamente tutti i libri di chimica usino la vecchia versione della tavola periodica, anche se il corretto posizionamento di La eAc è definito da più di 20 anni! Unamodifica importante sta nell’uso di simboli e unità raccomandate dalla IUPAC per le quantità termodinamiche. Per esempio, in questa edizione, le entalpie standard di reazione sono rappresentate dal simbolo (non ) e sono espresse in kJmol-1 (non kJ).
No customer comments for the moment.